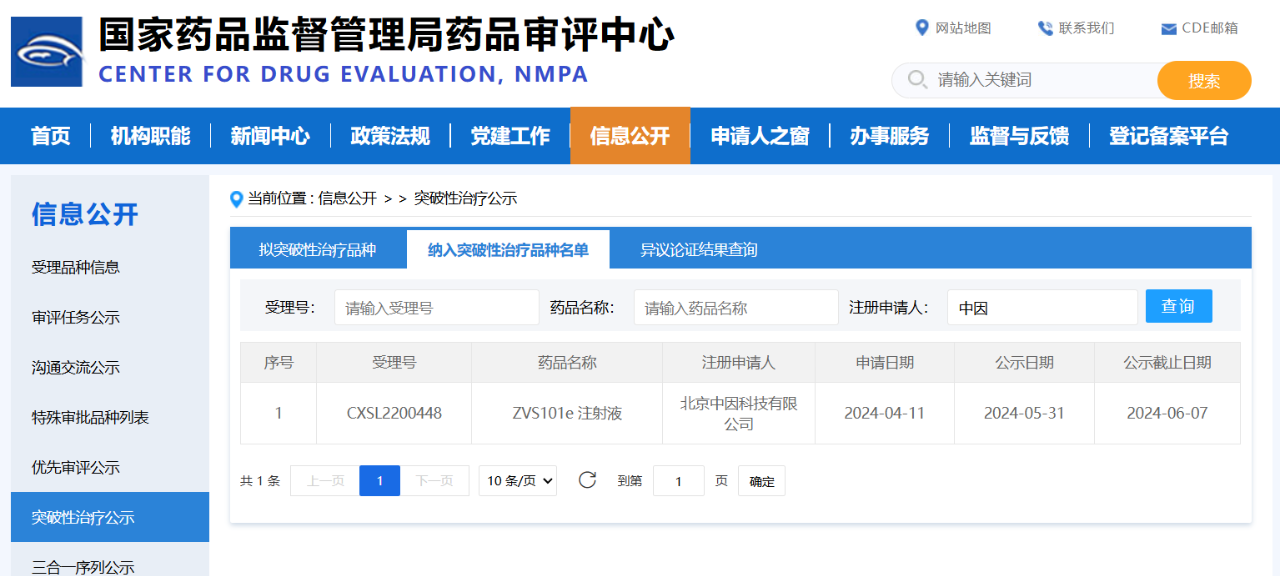
6月29日,根據國(guó)家藥品監督管理(lǐ)局藥品評審中(zhōng)心(CDE)官方網站顯示,北京中(zhōng)因科(kē)技(jì )有(yǒu)限公(gōng)司(以下簡稱中(zhōng)因科(kē)技(jì ))ZVS101e注射液已納入突破性治療品種名(míng)單,用(yòng)于治療結晶樣視網膜變性(BCD)。該裏程碑事件是ZVS101e注射液從科(kē)學(xué)理(lǐ)論論證到人體(tǐ)臨床應用(yòng)的重大突破,臨床上安(ān)全和有(yǒu)效性結果也證明了ZVS101e注射液優秀的臨床價值和未來上市的巨大潛力。
ZVS101e(rAAV8-hCYP4V2)研發理(lǐ)念由中(zhōng)因科(kē)技(jì )首席科(kē)學(xué)家、創始人楊麗萍研究員最早提出,經曆十餘年艱辛探索,在2021年首次開展研究者發起的臨床試驗,是國(guó)際範圍内針對BCD疾病的第一個基因治療臨床試驗(NCT04722107),同年獲得美國(guó)FDA的孤兒藥資格授權。2022年ZVS101e注射液獲得中(zhōng)美Investigational New Drug(IND)批件,2023年2月完成I/Ⅱ期臨床試驗首例受試者入組,是世界範圍内針對BCD開展的首個注冊性臨床試驗。目前該藥物(wù)已完成I/Ⅱ期臨床試驗,即将進入Ⅲ期臨床試驗階段,有(yǒu)望為(wèi)目前無藥可(kě)治的BCD疾病帶來突破性的治療前景,從而為(wèi)患者提供新(xīn)的、潛在的治療選擇。

中(zhōng)因科(kē)技(jì )是眼科(kē)基因治療引領者,專業從事遺傳眼病基因診斷和基因治療藥物(wù)開發的國(guó)家高新(xīn)技(jì )術企業,緻力于為(wèi)遺傳性眼病患者提供精(jīng)準診斷和治療“一站式”服務(wù)。中(zhōng)因科(kē)技(jì )基于診斷平台建立遺傳眼病數據庫及大隊列,總結出中(zhōng)國(guó)患者的突變頻譜,為(wèi)藥物(wù)研發提供治療靶點;在此基礎上開發具(jù)有(yǒu)獨立自主知識産(chǎn)權的藥物(wù),包括基因替代治療和基因編輯治療,力争實現“從零到一”的突破。目前已建立靶标篩選、基礎研究、動物(wù)實驗驗證、幹細胞驗證、AAV病毒研發和生産(chǎn)、臨床試驗運營和藥物(wù)注冊申報等完整的藥物(wù)開發體(tǐ)系。

北京首都科(kē)技(jì )發展集團有(yǒu)限公(gōng)司(以下簡稱“首發展集團”)是北京市科(kē)委、中(zhōng)關村管委會履行國(guó)有(yǒu)資産(chǎn)出資人職責的國(guó)有(yǒu)獨資公(gōng)司。2019年,首發展旗下北京首科(kē)開陽創業投資中(zhōng)心(有(yǒu)限合夥)參與完成對中(zhōng)因科(kē)技(jì )的天使輪投資。
版權聲明:
本文(wén)由“北京首都科(kē)技(jì )發展集團”公(gōng)衆号編輯,來源“中(zhōng)因科(kē)技(jì )”。